miércoles, 5 de junio de 2013
¿CÓMO PODEMOS AYUDAR A NUESTRO SISTEMA INMUNE?
Sabemos que el sistema inmunológico es el que se encarga de proteger el organismo de la invasión de bacterias, parásitos, virus y hongos. Estos seres microscópicos rodean nuestro cuerpo y siempre estamos en contacto con ellos. A medida que el clima va cambiando aumenta la cantidad de viruses, hongos, y cada vez llegan nuevos y desconocidos de estos microorganismos a invadir nuestro cuerpo. Les prestamos atención sólo cuando se manifiestan los signos de enfermedad que nos indican que el sistema inmunológico necesita ayuda. Otros factores que afectan al sistema inmunológico son; nuestro estado de ánimo, el estrés, los trastornos emocionales y la fatiga física, ya que estos reducen la producción de células de defensa y nos hacen más propensos a las infecciones. Podemos ayudar al sistema inmunológico de una forma natural utilizando plantas medicinales con el fin de restaurar la fortaleza del sistema. Entre estas plantas están las siguientes: La equinacia y el trébol rojo – estas ayudan a purificar la sangre y a renovar los tejidos. La equinacea se considera uno de los mejores antibióticos naturales por su capacidad para estimular el sistema inmunológico, produciendo más glóbulos blancos. La caléndula y el aloe vera – ayudan a calmar las irritaciones de la piel. El ajo y el tomillo – ayudan a destruir microorganismos. El jengibre y el romero – ayudan a fortalecer el organismo en períodos largos de mala salud y estimulan el sistema inmunológico. La melisa y la lavanda – reducen la ansiedad nerviosa. El diente de león y la ortiga – mejoran la eliminación. El limón y la naranja – levantan el ánimo y son una buena fuente de vitamina C. Vitaminas: Vitaminas del grupo B – se puede obtener de la levadura de cerveza, de las espinacas, trigo, cebada, avena, frutos secos, verduras, coliflor, los rábanos, las lechugas, etc. Vitamina C – esta es necesaria para poder absorber la vitamina A y E, ya que la deficiencia de esta en el cuerpo puede provocar una debilidad en los capilares. También es necesaria para la absorción del hierro, del calcio y otros aminoácidos. Algunos alimentos ricos en esta vitamina lo son los pimientos, las acerolas, limones, chinas, toronjas, etc. Vitamina A – su deficiencia puede provocar ceguera. Los alimentos que contiene esta vitamina son las zanahorias, calabaza, verdolaga, las espinacas, el tomate, espárragos, berro, el mamey, etc. Otras de las formas de proteger el sistema inmunológico es comiendo frutas, verduras, hierbas frescas, vegetales, tomar por lo menos seis vasos de agua fresca al día, practicar algún ejercicio, meditar y dar paseos al aire libre. Tener un sistema inmune fortalecido es la mejor garantía para no sucumbir ante las enfermedades, así que comienza desde hoy.
CICLO MENSTRUAL FEMENINO.
El ciclo sexual femenino humano (o ciclo menstrual) es el proceso mediante el cual se desarrollan los gametos femeninos (óvulos u ovocitos) y se producen una serie de cambios dirigidos al establecimiento de un posible embarazo. El inicio del ciclo se define como el primer día de la menstruación y el fin del ciclo es el día anterior al inicio de la siguiente menstruación. La duración media del ciclo es de 28 días, aunque puede ser más largo o más corto. A la primera menstruación se le denomina menarquia o menarca. Así como algunas niñas ingresan en la pubertad antes que otras, lo mismo ocurre con el período. La edad media de la menarquia es 12.5 años,1 pero varía de niña a niña (esto puede ocurrir entre 8-16 años). La menarquia no aparece hasta que todas las partes del aparato reproductor de una niña han madurado y están funcionando en conjunto. Esto indica el comienzo de la capacidad reproductiva. La menarquia es el principal marcador psicológico de la transición de la infancia a la edad adulta.
LOS NUTRIENTES.
| NUTRIENTES, QUE SON Y PARA QUE SIRVEN. |
Los alimentos contienen sustancias necesarias para la vida que llamamos nutrientes. Cada nutriente cumple con distintas funciones en nuestro organismo, siendo algunos de ellos esenciales. Esto último quiere decir que nuestro cuerpo por sí solo no los puede producir, de ahí que deban estar siempre presentes en aquellos alimentos que componen nuestra dieta diaria. Los nutrientes y sus funciones Los nutrientes se pueden clasificar según la función más destacable que desempeñan en nuestro cuerpo. De este modo nos encontramos con los siguientes tipos de nutrientes: Plásticos o de construcción: Forman parte de nuestras células, tejidos (músculo, huesos...), corazón, riñones, etc. Los nutrientes que llevan a cabo esta función son fundamentalmente las proteínas. Energéticos: Algunos de ellos son nuestra principal fuente de energía para poder funcionar correctamente cada día. Hablamos de los hidratos de carbono (energía de utilización rápida) y de las grasas (reserva de energía), los cuales nos permiten llevar a cabo todas las actividades del día, realizar ejercicio, etc. Reguladores: Permiten que tengan lugar en nuestro cuerpo todas las reacciones necesarias para su buen funcionamiento. Esta función la llevan a cabo las vitaminas, los minerales, el agua, la fibra, los antioxidantes y también ciertas proteínas que actúan como enzimas y hormonas.  |
LOS ALIMENTOS.
Los alimentos son sustancias necesarias para el mantenimiento de los fenómenos que ocurren en el organismo sano y para la reparación de las pérdidas que constantemente se producen en él. No existe ningún alimento completo, en nuestra dieta debemos incluir una diversidad de alimentos que hagan que ésta sea lo suficientemente rica como para poder mantener funcionando de manera correcta nuestro organismo.
Minerales.
Los minerales inorgánicos son necesarios para la reconstrucción estructural de los tejidos corporales además de que participan en procesos tales como la acción de los sistemas enzimáticos, contracción muscular, reacciones nerviosas y coagulación de la sangre. Estos nutrientes minerales, que deben ser suministrados en la dieta, se dividen en dos clases: macroelementos, tales como calcio, fósforo, magnesio, sodio, hierro, yodo y potasio; y microelementos, tales como cobre, cobalto, manganeso, flúor y cinc.
El calcio es necesario para desarrollar los huesos y conservar su rigidez. También participa en la formación del citoesqueleto y las membranas celulares, así como en la regulación de la excitabilidad nerviosa y en la contracción muscular. Un 90% del calcio se almacena en los huesos, donde puede ser reabsorbido por la sangre y los tejidos. La leche y sus derivados son la principal fuente de calcio.
VITAMINAS.
Son compuestos orgánicos que actúan sobre todo en los sistemas enzimáticos para mejorar el metabolismo de las proteínas, los hidratos de carbono y las grasas. Sin estas sustancias no podría tener lugar la descomposición y asimilación de los alimentos.
Ciertas vitaminas participan en la formación de las células de la sangre, hormonas, sustancias químicas del sistema nervioso y materiales genéticos. Las vitaminas se clasifican en dos grupos: liposolubles e hidrosolubles. Entre las vitaminas liposolubles están las vitaminas A, D, E y K. Entre las hidrosolubles se incluyen la vitamina C y el complejo vitamínico B.
Las vitaminas liposolubles suelen absorberse con alimentos que contienen esta sustancia. Su descomposición la lleva a cabo la bilis del hígado, y después las moléculas emulsionadas pasan por los vasos linfáticos y las venas para ser distribuidas en las arterias. El exceso de estas vitaminas se almacena en la grasa corporal, el hígado y los riñones. Debido a que se pueden almacenar, no es necesario consumir estas vitaminas a diario.
Minerales.
 |
Los minerales inorgánicos son necesarios para la reconstrucción estructural de los tejidos corporales además de que participan en procesos tales como la acción de los sistemas enzimáticos, contracción muscular, reacciones nerviosas y coagulación de la sangre. Estos nutrientes minerales, que deben ser suministrados en la dieta, se dividen en dos clases: macroelementos, tales como calcio, fósforo, magnesio, sodio, hierro, yodo y potasio; y microelementos, tales como cobre, cobalto, manganeso, flúor y cinc.
El calcio es necesario para desarrollar los huesos y conservar su rigidez. También participa en la formación del citoesqueleto y las membranas celulares, así como en la regulación de la excitabilidad nerviosa y en la contracción muscular. Un 90% del calcio se almacena en los huesos, donde puede ser reabsorbido por la sangre y los tejidos. La leche y sus derivados son la principal fuente de calcio.
VITAMINAS.
Son compuestos orgánicos que actúan sobre todo en los sistemas enzimáticos para mejorar el metabolismo de las proteínas, los hidratos de carbono y las grasas. Sin estas sustancias no podría tener lugar la descomposición y asimilación de los alimentos.
Ciertas vitaminas participan en la formación de las células de la sangre, hormonas, sustancias químicas del sistema nervioso y materiales genéticos. Las vitaminas se clasifican en dos grupos: liposolubles e hidrosolubles. Entre las vitaminas liposolubles están las vitaminas A, D, E y K. Entre las hidrosolubles se incluyen la vitamina C y el complejo vitamínico B.
Las vitaminas liposolubles suelen absorberse con alimentos que contienen esta sustancia. Su descomposición la lleva a cabo la bilis del hígado, y después las moléculas emulsionadas pasan por los vasos linfáticos y las venas para ser distribuidas en las arterias. El exceso de estas vitaminas se almacena en la grasa corporal, el hígado y los riñones. Debido a que se pueden almacenar, no es necesario consumir estas vitaminas a diario.
EL APARATO LOCOMOTOR.
Los huesos del esqueleto sostienen al cuerpo y dan protección a los órganos internos, como el corazón y los pulmones; mientras que los músculos brindan la flexibilidad y el movimiento, pues son capaces de contraerse y estirarse.
El cuerpo humano está formado por 206 huesos que trabajan en armonía para dar soporte al cuerpo. Los huesos pueden ser de diferentes tamaños y formas: los hay largos, cortos, planos o anchos. Los más largos están en las piernas y brazos, y los de menor tamaño en las falanges de los dedos y en la columna.

El fémur es el hueso del muslo y es el más grande de todos.
Casi todos los huesos de la cabeza son planos, unos pertenecen a la cara y otros al cráneo.
El tronco está formado por la columna vertebral y las costillas, de las cuales tenemos 12 pares que forman una caja para resguardar a órganos tan importantes como el corazón y los pulmones.
Los huesos de la cintura y cadera forman una especie de recipiente hondo que sirve también para proteger y sostener a los órganos internos.
Los brazos y piernas están formados por huesos largos. En su parte interna, los huesos contienen una sustancia llamada médula ósea. La médula de algunos huesos contribuye a la formación de la sangre, que es otra función muy importante del esqueleto.
Los huesos más pequeños forman los dedos de manos y pies.
El dedo pulgar es una gran herramienta que nos permite manipular muchos objetos.
En el nacimiento, los huesos no están tan duros como ahora, en ese periodo son suaves y formados de cartílago. Sin embargo, aún en el cuerpo de un niño quedan zonas formadas por cartílago, por ejemplo, las orejas o la punta de la nariz. Igualmente entre las vértebras de la columna hay cartílago, que evita que choquen bruscamente o que lastimen a los cordones nerviosos que van en su interior.
Un hueso se une a otro mediante articulaciones. Existen articulaciones que se mueven mucho, por ejemplo, las de los dedos, el codo o las rodillas; otras se mueven menos, como las de las vértebras de la columna, y también hay algunas fijas, por ejemplo, las que unen a los huesos de la cabeza entre sí.
Los huesos se unen en las articulaciones por medio de unos cordones musculares muy fuertes llamados ligamentos.
COMPUESTOS QUIMICOS.
En química , un compuesto es una sustancia formada por la unión de dos o más elementos de la tabla periódica. Una característica esencial es que tiene una fórmula química. Por ejemplo, el agua es un compuesto formado por hidrógeno y oxigeno en la razón de 2 a 1 (en número de átomos):  .
.
En general, esta razón es debida a una propiedad intrínseca (ver valencia). Un compuesto está formado por moléculas o iones con enlances estables y no obedece a una selección humana arbitraria. Por este motivo el bronce o el chocolate son denominadas mezclas o aleaciones, pero no compuestos.
Los elementos de un compuesto no se pueden dividir o separar por procesos físicos (decantación, filtración, destilación, etcétera), sino sólo mediante procesos químicos.

 .
.En general, esta razón es debida a una propiedad intrínseca (ver valencia). Un compuesto está formado por moléculas o iones con enlances estables y no obedece a una selección humana arbitraria. Por este motivo el bronce o el chocolate son denominadas mezclas o aleaciones, pero no compuestos.
Los elementos de un compuesto no se pueden dividir o separar por procesos físicos (decantación, filtración, destilación, etcétera), sino sólo mediante procesos químicos.

LAS REACCIIONES QUÍMICAS Y SU AJUSTE.
Las ecuaciones químicas son las representaciones de las reacciones químicas o transformaciones químicas, y constan de dos miembros; en el primero se indican las fórmulas de las sustancias iniciales, que se denominan reactivos, y en el segundo las de las sustancias que se obtienen, y se denominan productos. Los miembros se separan por una flecha (-->) para señalar el sentido de una reacción o dos flechas con los sentidos contrarios (<-->) para indicar que la reacción está en equilibrio, es decir, que coexisten sustancias reaccionantes y productos.
Como por ejemplo, en la combustión del metano se produce dióxido de carbono y agua. La ecuación que representa esta reacción es:
Como por ejemplo, en la combustión del metano se produce dióxido de carbono y agua. La ecuación que representa esta reacción es:
CH4 + O2 --> CO2 + H2O
Para que la ecuación cumpla con la ley de conservación de la masa es imprescindible que esté ajustada o igualada, es decir, que haya el mismo número de átomos en cada miembro de la ecuación. Se utilizan entonces unos números, los coeficientes estequiométricos, que se colocan delante de las fórmulas e indican el número relativo de moléculas.
CH4 + 2 O2 --> CO2 + 2 H2O
En determinados casos hace falta especificar el estado físico: sólido (s), líquido (l), gas (g), o disolución acuosa (aq), en que se encuentran las sustancias en las condiciones de la reacción.
CH4(g) + 2 O2(g) --> CO2(g) + 2 H2O(l)
En las ecuaciones ajustadas podemos hacer dos lecturas: una microscópica, por ejemplo, una molécula de metano con dos moléculas de oxígeno produce una molécula de dióxido de carbono y dos de agua, esto es poco práctico aunque didáctico porque nunca vamos a trabajar con tan poca materia, más interesante es la lectura macroscópica, por ejemplo, un mol de metano con dos moles de oxígeno produce un mol de dióxido de carbono y dos moles de agua. Esto será particularmente útil cuando realicemos cálculos estequiométricos.
Si en la reacción intervienen ións, hay que igualar, además, eléctricamente, para que cumpla la ley de conservación de la carga. Como por ejemplo:
Si en la reacción intervienen ións, hay que igualar, además, eléctricamente, para que cumpla la ley de conservación de la carga. Como por ejemplo:
Zn + Ag+ --> Zn2+ + Ag
Zn(s) + 2 Ag+(aq) --> Zn2+(aq) + 2 Ag(s)
Método para ajustar ecuaciones químicas: el método más sencillo es el de tanteo, se contarán los átomos de cada elemento en reactivos y productos y se colocarán los coeficientes delante de las fórmulas para que los elementos queden igualados, debes dejar para ajustar al final los elementos que aparezcan en varias fórmulas en reactivos o productos. Ten en cuenta que al ajustar un elemento puedes desajustar otro, por tanto repasa todo al final.
Un ejemplo: Combustión del propano
Un ejemplo: Combustión del propano
C3H8 + O2 --> CO2 + H2O
El oxígeno participa en más de un compuesto en productos, lo dejaremos para el final. Empezamos por el C, 3 carbonos en reactivos y 1 carbono en productos, necesitamos 3 moléculas de CO2 para ajustarlo.
C3H8 + O2 --> 3 CO2 + H2O
Seguimos con el H, 8 hidrógenos en reactivos y 2 hidrógenos en productos, necesitamos 4 moléculas de H2O para ajustarlo.
C3H8 + O2 --> 3 CO2 + 4 H2O
Sólo nos faltan los O, 2 oxígenos en reactivos y 3·2+4·1=10 en productos, necesitamos 5 moléculas de O2 en reactivos para ajustarlo.
C3H8 + 5 O2 --> 3 CO2 + 4 H2O
Ya está la ecuación ajustada, el coeficiente del propano es 1 aunque no se escriba, pero en los ejercicios sí lo tienes que escribir. Recuerda que lo que no puedes modificar son los coeficientes de cada elemento dentro de las moléculas, ya que cambiarías las sustancias, sólo podemos modificar el número de moléculas.
Rocas sedimentarias
ROCAS SEDIMENTARIAS DETRÍTICAS son las formadas a partir de la sedimentación de trozos de otras rocas después de una fase de transporte. La clasificación de estas rocas se basa en los tamaños de los trozos que las componen. Las constituidas por trozos de tamaño grande son los conglomerados, las areniscas poseen granos de tamaño intermedio y los limos y arcillas poseen trozos muy pequeños
ROCAS SEDIMENTARIAS QUÍMICAS Y ORGÁNICAS son las formadas a partir de la precipitación de determinados compuestos químicos en soluciones acuosas o bien por acumulación de substancias de origen orgánico. Un tipo muy común es la roca caliza, formada en su mayor parte por restos de organismos como corales, algas, etc. aunque también puede originarse por precipitación de cementos calcáreos. Las tobas calcáreas son rocas muy porosas y con abundantes restos vegetales que se originan en los ríos cuando el carbonato de calcio precipita sobre la vegetación.

Acción geológica del mar
Los depósitos debidos a la acción del mar son acumulaciones de los sedimentos transportados por las olas, las corrientes y las mareas. Aparecen en zonas tranquilas y protegidas de las costas bajas. Hay diversos tipos de depósitos debidos a la acción marina, como las playas, los tómbolos, las barras de arena y las flechas.
Las playas son depósitos de arena en la misma línea de costa. Frecuentemente la arena está formada por partículas de las rocas erosionadas en zonas cercanas, aunque en su composición también intervienen partículas de carbonato cálcico procedentes de la fragmentación de las numerosas conchas de moluscos que se acumulan en el fondo marino.Entre las formaciones que se originan por los depósitos de arena fuera de la línea de la costa, destacan los tómbolos, las barras de arena y las flechas.
Un tómbolo es un depósito de arena que une un islote con la costa. Una barra de arena o cordón litoral es un cúmulo de arena alargado y paralelo a la costa, pero que no se une a ella.
Una flecha es un depósito arenoso alargado unido a la costa por un extremo. Si este depósito crece y se une a la costa por el extremo libre, se forma una albufera o laguna costera aislada del mar.
Otras formaciones asociadas a la costa son las marismas, zonas pantanosas originadas por la acumulación de sedimentos en una bahía o en una albufera. Estos sedimentos proceden, frecuentemente, de los ríos.

Acción geológica del viento
El viento actúa en toda la superficie terrestre,dependiendo de su situación geográfica, del clima predominante, etc...
La acción del viento produce la erosión de los materiales, el transportes de los mismos y su depósito cuando su cantidad disminuye.
La erosión ocurre por dos procesos:
•Deflacción: el viento arrastra las partículas de menor tamaño y las mantiene en suspensión y las de mayor tamaño son transportadas por saltación y por arrastre.
•Abrasión eólica: Se produce por el choque de las partículas que lleva en suspension el viento.La abrasion es más intensa en la zonas cercanas al suelo, pueden transportar particulas de mayot tamaño.
Así se generan las acanaladuras en la superficie de las rocas producida por la abrasion del viento, produce arcos naturales, rocas fungiformes y alveolos.

Acción geológica del hielo
Los glaciares son masas de hielo en movimiento que cubren el 10% de la superficie terreste.
Se localizan el las regiones del planeta donde las precipitaciones son de nieve y la temperatura no supera los 0º.
Estas caracteristicas se encuentran en las regiones polares y en aquellas montañas cuya altura compensa su latitud,de forma que podemos encontrar glaciares en zonas casi ecuatoriales, como ocurre en los continentes africanos y americano.
Los glaciares se forman por acumulación,compactación y recristalización de la nieve.

Acción geológica de las aguas subterraneas
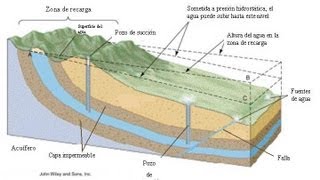
Las aguas subterráneas son aquellas que se encuentran en capas más o menos profundas en el subsuelo. Su origen está en las aguas superficiales que se filtran hasta alcanzar una capa impermeable a partir de la que se almacena. Su proporción es, en general, inversa a la de las aguas superficiales, es decir, dependen de la mayor o menor cantidad de precipitaciones, tanto de agua como de nieve, que se filtre. Esta filtración depende de la naturaleza del terreno de la pendiente, de la porosidad y, fundamentalmente, de la vegetación. El nivel del agua en profundidad se denomina “nivel freático” y es más o menos uniforme para una amplia zona
La acción geológica de las aguas subterráneas es muy potente, independientemente de la velocidad con la que discurren las aguas, que es una velocidad muy lenta.
Acción de las aguas superficiales
Aguas superficiales son aquellas que circulan sobre la superficie del suelo. Esta se produce por la escorrentía generada a partir de las precipitaciones o por el afloramiento de aguas subterráneas. Pueden presentarse en forma correntosa, como en el caso de corrientes, ríos y arroyos, o quietas si se trata de lagos, reservorios, embalses, lagunas,humedales, estuarios, océanos y mares.

Agente geológico externo
La energía que proviene del Sol es la responsable de la aparición de los agentes geológicos externos.
Ya que la Tierra es redonda, algunas zonas reciben más energía que otras. Los movimientos que se producen en la Atmósfera y la Hidrosfera movilizan la energía desde las zonas más cálidas a las más frías. Estos movimientos son los responsables del modelado del relieve del Planeta, porque producen la intervención de los agentes geológicos externos.

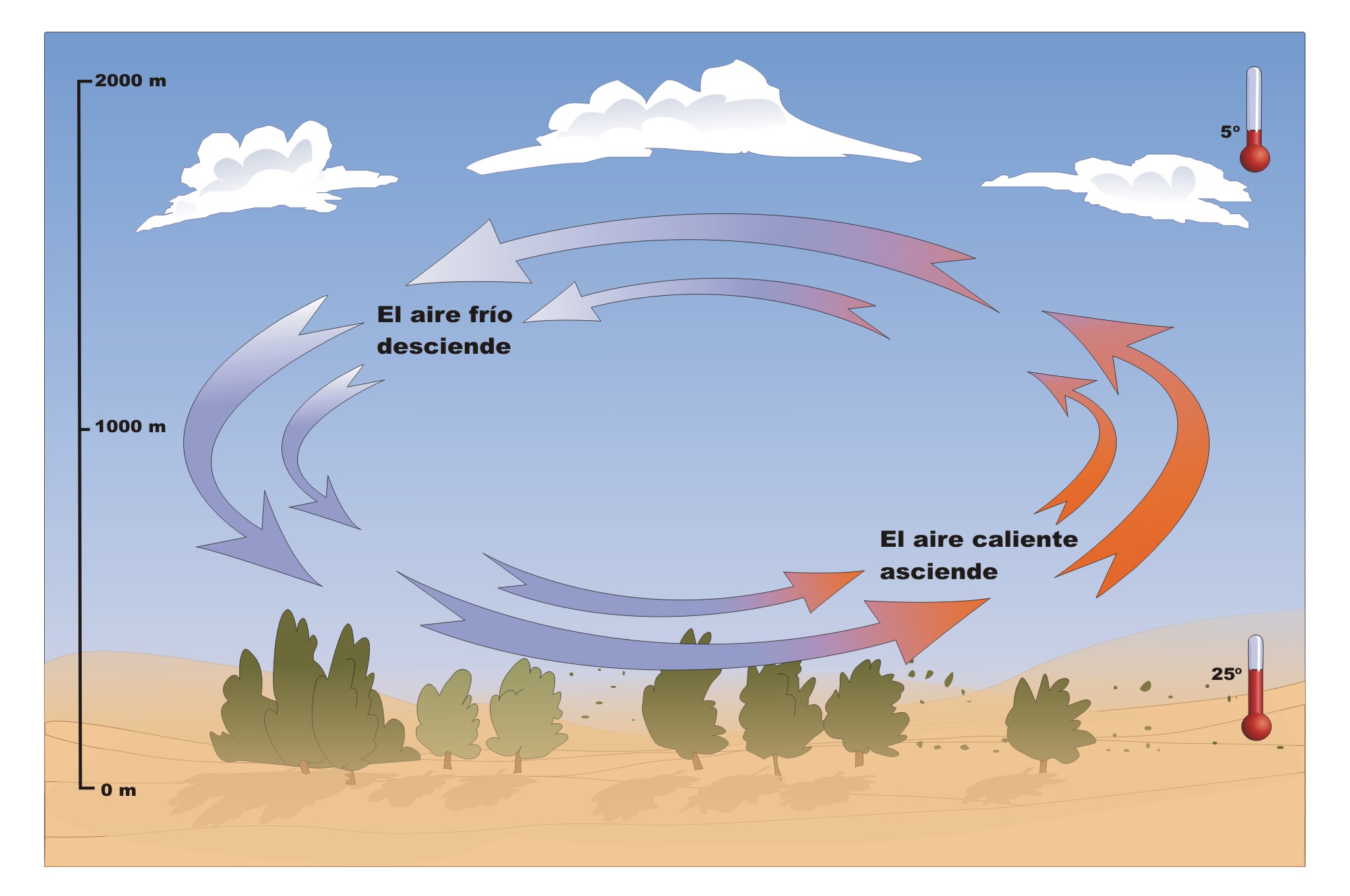
Dinámica atmosferica
Se llama dinámica de la atmósfera o dinámica atmosférica a una parte de la Termodinámica que estudia las leyes físicas y los flujos de energía involucrados en los procesos atmosféricos. Estos procesos presentan una gran complejidad por la enorme gama de interacciones posible tanto en el mismo seno de la atmósfera como con las otras partes (sólida y líquida) de nuestro planeta.
Atmósfera
La atmósfera terrestre es la parte gaseosa de la Tierra, siendo por esto la capa más externa y menos densa del planeta. Está constituida por varios gases que varían en cantidad según la presión a diversas alturas. Esta mezcla de gases que forma la atmósfera recibe genéricamente el nombre de aire. El 75% de masa atmosférica se encuentra en los primeros 11 km de altura, desde la superficie del mar. Los principales elementos que la componen son el oxígeno(21%) y el nitrógeno (78%).
La atmósfera y la hidrosfera constituyen el sistema de capas fluidas superficiales del planeta, cuyos movimientos dinámicos están estrechamente relacionados. Las corrientes de aire reducen drásticamente las diferencias de temperatura entre el día y la noche, distribuyendo el calor por toda la superficie del planeta. Este sistema cerrado evita que las noches sean gélidas o que los días sean extremadamente calientes.
martes, 28 de mayo de 2013
EL SOL, FUENTE DE ENERGIA.
El sol es la estrella del sistema solar. Se formó hace 5 millones de años y todavía seguirá luciendo otros tantos.
En una esfera ligeramente achatada por los polos, debido al movimiento de rotación sobre su eje, que dura entre 25 días en los puntos situados en los polos y 36 días en los situados en el ecuador. El sol genera un campo gravitatorio en todo el sistema solar.
ATMÓSFERA.
La tierra es unos de los planetas que giran alrededor del sol, describiendo órbitas casi circulares. Está rodeada por una capa llamada atmósfera compuesta por gases que llamamos aire.
La atmósfera se divide en cinco partes:
Troposfera: Es la capa que está en contacto con el suelo y tiene entre 11 y 12 km de altura.
Estratosfera: Abarca desde los 11 a los 50 km, aumentando la temperatura hasta llegar a 17 ºC
Exosfera: Es la zona más exterior de la atmósfera (frontera entre la atmósfera y el espacio exterior), y alcanza distancias de más de 1.000 km. La temperatura en esta zona es de 2.400 ºC, aproximadamente

En una esfera ligeramente achatada por los polos, debido al movimiento de rotación sobre su eje, que dura entre 25 días en los puntos situados en los polos y 36 días en los situados en el ecuador. El sol genera un campo gravitatorio en todo el sistema solar.
ATMÓSFERA.
La tierra es unos de los planetas que giran alrededor del sol, describiendo órbitas casi circulares. Está rodeada por una capa llamada atmósfera compuesta por gases que llamamos aire.
La atmósfera se divide en cinco partes:
Troposfera: Es la capa que está en contacto con el suelo y tiene entre 11 y 12 km de altura.
Estratosfera: Abarca desde los 11 a los 50 km, aumentando la temperatura hasta llegar a 17 ºC
Mesosfera: Se encuentra entre 50 y 90 km de altura aproximadamente. A esta zona llegan la mayor parte de los rayos ultravioletas del sol, que provocan reacciones químicas en el aire, y es aquí donde los meteoritos que caen en la Tierra se vuelven incandescentes convirtiéndose en las estrellas fugaces o lluvias de estrellas.
Ionosfera: Esta capa llega hasta los 500 km de altura y contiene gases ionizados, cargados eléctricamente debido a los rayos cósmicos.Exosfera: Es la zona más exterior de la atmósfera (frontera entre la atmósfera y el espacio exterior), y alcanza distancias de más de 1.000 km. La temperatura en esta zona es de 2.400 ºC, aproximadamente
CONTAMINACIÓN E IMPACTO AMBIENTAL.
Contaminación es la presencia en el ambiente de cualquier agente o contaminante que produce consecuencias negativas sobre el medio ambiente.
Se denomina impacto ambiental al conjunto de posibles efectos negativos sobre el medio ambiente,dando lugar a una modificación del entorno natural como consecuencia de las actividades humanas.
Según el medio al que afectan,podemos hablar de:
-Impacto en la atmósfera: Producidos por emisiones gaseosas y sólidas a la atmósfera.
-Impacto en la hidrosfera: Producidos por el vertido de todo tipo de sustancias a la hidrosfera.
-Impacto en el suelo: Producidos por la erosión o por el vertido de distintas sustancias sobre la superficie terrestre.
-Impacto en la biosfera: Debido a la degradación de los ecosistemas,pérdida de diversidad,extención de especies,etc..
IMPACTO EN LA ATMÓSFERA.
La industria,el aumento del uso de vehículos,de las calefacciones....generan cada año miles de millones de contaminantes que se emiten a la atmósfera.Los más frecuentes son el monóxido y el dióxido de carlos CFC y las partículas en suspensión.
Destrucción de la capa de ozono.
El ozono es un gas azulado,compuesto por 3 átomos de oxígeno,O3,que se encuentra en la estratosfera,a una altura de entre 20 y 30 km.Su papel consiste en absorber la mayor parte de los rayos ultravioletas emitidos por el sol,muy perjudiciales para la salud.
El efecto invernadero.
Consiste en el calentamiento excesivo de la atmósfera y de la superficie terrestre, debido a que gran parte de los gases atmosféricos absorben calor. En principio es un efecto natural que sirve para mantener constante la temperatura media del planeta.
El aumento de temperatura en las capas bajas de la atmósfera se debe fundamentalmente a la presencia de grandes cantidades de dióxidos de carbono procedente de la industrias, calefacciones y los motores de los vehículos.
La lluvia ácida.
Consiste en el calentamiento excesivo de la atmósfera y de la superficie terrestre, debido a que gran parte de los gases atmosféricos absorben calor. En principio es un efecto natural que sirve para mantener constante la temperatura media del planeta.
El aumento de temperatura en las capas bajas de la atmósfera se debe fundamentalmente a la presencia de grandes cantidades de dióxidos de carbono procedente de la industrias, calefacciones y los motores de los vehículos.
La lluvia ácida.
La lluvia ácida corroe muchos metales y materiales de construcción como el mármol y la piedra caliza, cuyo componente fundamental es el carbonato de calcio. Los monumentos realizados con hierro o cobre son atacados por el dióxido de azufre y sufren graves deterioros.
LOS SANTOS INOCENTES
FICHA TÉCNICA:
Titulo original: Los santos inocentes.
Dirección: Mario Camus.
País: España.
Año: 1984
Fecha de estreno: 04/04/1984
Duración: 107 min
Género: Drama.
Calificación: No recomendada a menores de 13 años.
Reparto: Alfredo Landa,Terele Pávez,Bélen ballesteros,Juan sachez,Susana Sánchez,Francisco Rabal,Ágata Lys,Agustin González,Juan Diego,Mary carrillo.
Distribuidora: United International,Pictures,(UIP)
Productora: Televisión Española(TVE),Ganesh Producciones Cinematográficas.
ARGUMENTO:
En la película nos hace ver las clases de familia que había en esta época, había dos clases de familias, los ricos y los pobres, que eran los que hacían todas las cosas que los ricos, les mandaban y todo tipos de trabajo duros que los ricos no lo querían hacer.La forma en la que vivían, vestían y comían nos hace ver las clases de gentes que eran.
PERSONAJES:
Paco, el Bajo (Alfredo Landa)
PERSONAJES:
Paco, el Bajo (Alfredo Landa)
Paco es la bondad y posee un profundo humanismo. Pacientemente soporta las particularidades de su cuñado retrasado y aguanta impasiblemente los gritos horribles de su hija minusválida, Rosario, la Niña Chica, que perjudican su vida sexual.
Régula (Terele Pávez)
Regula es el sufrimiento femenino, la rabia tragada, la humildad y paciencia.
Azarías (Paco Rabal)
Azarías es el hermano retrasado de Regula. Junto con la Niña Chica representa los verdaderos santos inocentes de la narración, seres que no se pueden defender personalmente. Gracias a su retraso mental, tiene una libertad de acción del Cortijo de la cual no dispone ninguno de los otros personajes. Según las ganas, visita a su hermana en vez de trabajar, y se desahoga por cualquier parte.
Es una persona marginada que se encuentra en una estrecha relación con la naturaleza.
El señorito Iván (Juan Diego)
El señorito Iván es un perfecto retrato del hijo de papá, el niño bien y sabelotodo, el perdonavidas armado, el macho ibérico, el sicario sin entrañas, en definitiva el pobre diablo, el verdadero imbécil.
La Marquesa (Mary Carrillo)
Arriba, intocable, perfecta, rubia, aparentemente limpia, como el poder constituido que se atreve a regalar, a bendecir desde su palmaria injusticia.
La señorita Miriam (Maribel Martín)
Miriam es la hija de la marquesa y la hermana de Iván. Dentro de la clase dirigente es la persona con el carácter más positivo. Destaca la naturalidad con la que trata a otras personas y su capacidad de sentir compasión e interés.
Don Pedro (Agustín González)
Don Pedro Crespo es el Guarda Mayor del Cortijo y, como ejecutivo de los terratenientes, forma parte de los opresores.
OPINIÓN PERSONAL:
La película me ha parecido interesante porque nos enseña a valorar las clase de tipo de personas que hay en el mundo. Hay personas que se creen que porque tengan mucho dinero es más que tu o superior a ti. Y me parece muy interesante porque nos hace ver la vida de otra manera.
viernes, 17 de mayo de 2013
TIPOS DE REACCIONES QUÍMICAS.
Reacción de síntesis:
En este tipo de reacciones,dos o más sustancias se combinan para formar una nueva.
Reacción de descomposición:
Es el proceso contrario al anterior.Una sustancia se descompone en otras más sencillas.
Reacción de sustitución:
Cuando un elemento es desplazado o sustituido por otro.
Reacciones de oxidación y reducción:
Antiguamente,la oxidación se definía como la reacción de una sustancia con oxigeno para obtener otras sustancias que lo contuvieran en su composición.
Un Reductor es toda sustancia que cede electrones y produce la reducción de otra.El oxidante disminuye su número de oxidación.Los metales,los sulfitos,el carbono y el monóxido de carbono son reductores.
Un oxidante es toda sustancia que gana electrones y produce la oxidación de otra.El oxidante disminuye su número de oxidación.El oxígeno,el ácido nítrico y los halógenos,son oxidantes.
Reacciones exotérmicas.
Son aquellas en la que la energía se desprende en forma de calor.Entre estas reacciones se encuentran las reacciones de combustión.
Reacciones endotérmicas.
Son aquellas que absorben energía del exterior,en forma de calor,luz,etc.Una de las reacciones endotérmicas más importantes es el proceso de fotosíntesis.
ENLACES QUÍMICOS.
Los átomos se unen mediante los electrones más externos para alcanzar una situación de mayor estabilidad,como la de los gases nobles,cuya última capa está completa con 8 electrones.Según como se produzca esta unión entre los átomos,nos encontramos con tres tipos de enlaces.
Enlace iónico:Cuando se unen un metal con un no metal.Por ejemplo la sal de mesa constituida por cloro y sodio.
Enlace covalente:Cuando se unen un no metal con otro no metal.Por ejemplo,la molécula de oxígeno.
Enlace metálico:Típico de los metales.El cobre,el hierro o la plata tienen este enlace.
COMPUESTOS QUÍMICOS
En nuestra vida diaria nos encontramos con numerosos compuestos químicos:Ácidos,sales,hidróxidos,etc.-veamos algunos ejemplos:
-La sal común es el cloruro de sodio-NaCI
-El dióxido de carbono provienen de los coches se formula-CO2
-El agua oxigenada que hay en casa es el peróxido de hidrógeno-H2O2
-La cáscara del huevo es carbonato de calcio-CaCO3
LAS REACCIONES QUÍMICAS Y SU AJUSTE.
Una reacción química es un proceso en el que una o más sustancias (reactivos) reaccionan para dar otras sustancias con propiedades diferentes (productos).Una reacción química se representa por medio de ecuaciones químicas en las que se escriben las fórmulas de los reactivos en el primer miembro y,en el segundo,las de los productos.
Los miembros están separados por una flecha que indica el sentido en el que transcurre la reacción por ejemplo,H2+O2-H2O
Una reacción química debe estar ajustada,es decir,el número de átomos de los elementos que forman las sustancias debe ser el mismo en ambos miembros de la reacción.
MOLÉCULAS,ELEMENTOS Y COMPUESTOS.
Los átomos pueden unirse entre si o con otros átomos distintos.Así,el oxigeno se presenta como O2 o combinando con otros elementos,por ejemplo con el hidrógeno,para formar el agua,H2O.
Un elemento es una sustancia pura que no se puede separar en otras más simples,por ejemplo el cobre.mientras que un compuesto es una sustancia que se puede separar en otras más simple o elementos,por ejemplo la sal común (cloruro de sodio)que se puede separar en cloro y sodio.
NOMBRE Y SÍMBOLO DE LOS ELEMENTOS.
Actualmente se conocen 118 elementos,de los que unos 90 se encuentran en la naturaleza y el resto se han obtenido en el laboratorio o aún no han sido aislados.
Muchos de sus nombres derivan del latín o del griego,como el plutonio en honor al dios plutón,o se refieren a sus propiedades físicas o químicas;el yodo proviene de iodes,que significa color violeta.
Cada elemento químico se representa por símbolo,convenido internacionalmente,constituido por una o dos letras de su inicial y que se suele emplear como abreviatura de su nombre.Por ejemplo;H es hidrógeno y B es boro.
TABLA PERIÓDICA.
Los científicos colocaron los elementos,en función de sus características físicas y químicas,en una tabla,la tabla periódica,agrupándolos de acuerdo con esas propiedades que se repiten de forma regular (periódica).
La tabla periódica está formada por 18 columnas,o grupos,y 7 filas,o periodos.
Los elementos se pueden clasificar en:
Metales:Situados a la izquierda de la tabla.Conducen bien la electricidad.
No Metales:Situados a la derecha.Son malos conductores de la electricidad.
Semimetales o Semiconductores:Situados entre los metales y los no metales,actualmente tienen gran importancia debido a su utilización para construir los componentes electrónicos.

miércoles, 15 de mayo de 2013
ESTRUCTURA DEL ÁTOMO
Como ya hemos visto,Rutherford consideraba que el átomo estaba dividido en dos partes muy diferenciadas:núcleo y corteza.
En el núcleo se encuentran los protones y los neutrones,que constituyen la mayor parte de la masa de átomo.Los protones tienen carga positiva y los neutrones no tienen carga.Orbitando alrededor del núcleo se encuentra los electrones,con carga eléctrica igual a la del protón pero negativa.
Los átomos de los diferentes elementos se diferencian en el número e protones que tiene su núcleo.A este número se le llama número atómico y se representa con la letra Z.Los átomos de los distintos elemntos se diferencian por este número.
La masa del átomo depende principalmente del número de protones y neutrones que tiene dicho átomo.
El número másico (A)nos indica la cantidad de protones y neutrones que tiene el átomo.Es decir:A=Z+N
Los electrones se disponen en capas alrededor del núcleo atómico.Cada capa puede tener un número máximo de electrones:2,8,18,32,etc..,excepto la última capa que solo puede albergar un máximo de 8 electrones.Esta capa más externa del átomo es la que determina las propiedades químicas del elemento.A los electrones de esta capa se les llama electrones de valencia.si la última capa está completa,eñ átomo es más estable;por ejemplo los gases nobles.Por eso,todos los átomos tienden a tener esos 8 electrones externos y para ello los átomos con pocos electrones en la última capa tienden a perderlos,convirtiéndose en iones positivos o cationes,mientras que los átomos que poseen un número de electrones cercano a 8 tienden a ganar los que necesitan,quedando como iones negativos o aniones.
ISÓTOPOS.
Los isótopos,por ser átomos del mismo elemento,tienen el mismo número de protones y,por tanto,idéntico número atómico.En el caso del carbono Z es igual a 6 para todos sus isótopos.Uno de los isótopos más conocidos es el carbono 14 (C-14) que nos permite fechar restos de varios miles de años de antiguedad.
MODELOS ATÓMICOS
La historia de los modelos atómicos comienzan en el siglo V a.C.,cuando algunos filósofos griegos,como Demócrito,proponen que la materia no puede dividirse en trozos más pequeños indefinidamente,sino que existen unas particulas muy pequeñas,eternas,invisibles e indivisibles que lo constituyen todo.A estas partículas las llamaron átomos (indivisible,en griego).
John Dalton (1808)
Basándose en las observaciones sobre conservación de la masa en reacciones químicas,este científico inglés publicó,en 1808,una teoría que establecía que:
-La materia está formada por partículas indivisibles e indestructibles(los átomos).
-Todos los átomos que forman un elemento son idénticos.
-Combinando átomos de distintos elementos en proporciones fijas se forman los compuestos(esto es lo que sucede en las reacciones químicas).
Joseph John Thomson (1897)
En 1897,J.J. Thomson descubrió la existencia del electrón.Se comprobó experimentalmente que su masa era mucho menor que la de los átomos y que poseía carga negativa.Con estos datos,Thomson elaboró un modelo que pasó a sustituir al modelo de Dalton.
En este modelo se consideraba que los átomos sí eran divisibles ya que que estaban formados por una esfera de carga positiva,dentro de la cual se encontraban inmersos los electrones (de carga negativa).La mayor parte de la masa del átomo se hallaba en la esfera positiva.
Ernest Rutherford (1911)
En 1911,los colaboradores del científico británico Ernert Rutherford descubrieron que algunas de las partículas alfa lanzadas contra láminas muy finas de oro se desviaban a más de 90º de su trayectoria inicial.Este dato era sorprendente,ya que el suceso equivalía a ver rebotar una bala cuando intenta atravesar una hoja de papel.
Para explicar este fenómeno,Rutherford construyó un modelo atómico en el que situaba la mayor parte de la masa del átomo y su carga positiva en una región central muy pequeña,denominada núcleo.En torno al núcleo orbitan los electrones,en un espacio vacio mucho más amplio llamado corteza.
Este modelo ha sido corregido posteriormente por la moderna mecánica cuántica,pero es la base e la idea más extendida sobre la estructura atómica.
SUSTANCIAS PURAS Y MEZCLAS.SEPARACIÓN DE MEZCLAS.
Sustancias es cada una de las diversas clases de materia que existen en la naturaleza.Podemos clasificar las sustancias que nos encontramos a nuestro alrededor según la cantidad de elementos que contienen y la organización de estos.
Sustancias puras:
Son sustancias constituidas por un único componente y propiedades físicas características.Algunas de estas propiedades son;la temperatura,el color,la densidad,el sabor....Un ejemplo de sustancias pura es el azúcar.
Mezclas:
Están formadas por la unión de varias sustancias puras.Las sustancias que forman las mezclas conservan sus propiedades y pueden separarse utilizando medios físicos.Estudiaremos algunos de estos métodos más adelante.
Mezclas heterogéneas:
Algunas mezclas presentan un aspecto irregular y pueden distinguirse a simple vista las distintas sustancias que las componen.Además,las propiedades de estas mezclas varían de un punto a otro de las mismas.
Se denominan entonces mezclas heterogéneas.Algunos ejemplos de este tipo de mezclas son el granito y el agua con aceite.
Mezclas homogéneas o disoluciones.
Habitualmente,al componente más abundante de la disolución se le denomina disolvente,mientras que a las demás sustancias que la forman se las llama solutos.En el caso del agua con azúcar,por ejemplo,el agua sería el disolvente y el azúcar,el soluto.
La cantidad de soluto que hay en una disolución se mide mediante la concentración.Una disolución un poco concentrada (es decir,un poco soluto) está más diluida que una de mayor concentración(con mucho soluto).
Para expresar la concentración suele indicarse la cantidad de soluto que está presente en una cierta cantidad de disolución(por ejemplo,los gramos de soluto en un litro de disolución) o el porcentaje que supone el soluto del peso o el volumen total de la disolución.
Las opciones son:
-Gramos por litro(g/L):Indica los gramos de soluto que hay en una litro de disolución.
-Tanto por ciento en masa:Indica qué porcentaje de la masa total de la disolución es soluto.
-Tanto por ciento es volumen:Indica qué poMezclas homogéneas o disoluciones.rcentaje del volumen total de la disolución es el soluto.
CAMBIOS DE ESTADO.
El estado de una sustancia está determinado por su temperatura.El efecto del calor sobre las sustancias es el principal responsable de los cambios de estado de las sustancias.Estas pueden cambiar de estado si las calientas o enfría lo suficiente.
CAMBIO DE ESTADO:DE SÓLIDO A LÍQUIDO
-El paso de sólido a líquido por medio del calor se denomina fusión.
En el estado sólido las partículas están muy cerca unas de otras formando un bloque compacto.Si calentamos el sólido,la agitación y vibración de las partículas aumenta y las fuerzas que unen las particulas se van debilitando con el calor.
Cada cuerpo sólido funde a una temperatura fija y determinada,llamada temperatura de fusión.Para el hielo,esta temperatura es de cero grados centígrados,0 ºC.
CAMBIO DE ESTADO:DE LÍQUIDO A GAS.
-El paso de líquido a gas por medio del calor se denomina vaporización.
Si calentamos un líquido,llegara un momento en que los débiles enlances entre sus partículas se rompan y dejen las partículas libres:el líquido ha pasado a gas.
La evaporación puede producirse de dos formas:
-Evaporación:Es una vaporización lenta que se realiza solo en la superficie libre del líquido y a cualquier temperatura.
-Ebullición:Se produce cuando el líquido alcanza su temperatura de ebullición.
La temperatura de ebullición del agua es de 100 ºC.Cuando el agua alcanza esa temperatura decimos que hierve.
ESTADOS DE LA MATERIA:LA TEORÍA CINÉTICA
La materia se puede presentar en tres Estados:
-Estado Sólido:
-Los sólidos tienen una masa constante.
-Su volumen también es fijo.
-Es muy difícil deformar los cuerpos sólidos.
-Tienen forma propia y fija.La interacción entre sus partículas es muy fuerte y estas están muy próximas entre sí.
-Estado Liquido:
-Los cuerpos líquidos tienen una masa constante.
-Igual que los sólidos,su volumen es constante.
-Menor interacción entre sus partículas;están más separadas.Por ello,los líquidos,a diferencia de los sólidos,no tienen forma propia ya que adoptan la forma del recipiente que los contiene,sin cambiar de volumen.Si vierto agua en un vaso,adoptará la forma del vaso,pero si la vierto en una botella,tendra la forma de la botella.
-Estado Gaseoso:
-Los gases tienen una masa constante,igual que los sólidos y los líquidos.
-Su volumen no es constante,pues puede disminuir si se aplican fuerzas sobre él,y aumentar si desaparecen esas fuerzas.
-En los gases,la interacción entre sus partículas es muy débil y se pueden mover libremente.No presentan forma propia,ya que adquieren la forma del recipiente que los contiene.
lunes, 13 de mayo de 2013
LA MATERIA.
Podemos decir que la materia es todo lo que tiene masa y ocupa un volumen.La materia se representa con muchos aspectos diferentes,formando los distintos cuerpos materiales que están a nuestro alrededor por ejemplo,madera,cristal....
PROPIEDADES GENERALES DE LA MATERIA.
-Masa:Es la cantidad de materia que tiene un cuerpo,y se mide en kilogramos(Kg).
-Volumen:Es la porción del espacio que ocupa un cuerpo.El volumen tiene tres dimensiones:ancho y alto,como por ejemplo,un libro.
-Superficie:Todos los cuerpos materiales tienen unas dimensiones,es decir,se pueden medir.Si el objeto tiene dos dimensiones,ancho y alto,nos estamos refiriendo a una superficie,por ejemplo,una hoja de papel.
-Densidad:Es una propiedad que depende de la masa y del volumen.La densidad es una propiedad característica que permite distinguir los diferentes tipos de materia.Se define como la masa que contiene la unidad de volumen de un cuerpo.
Suscribirse a:
Entradas (Atom)
